方法驗證和方法確認的區別與聯系
在分析化學和相關領域中,方法驗證(Method Validation)和方法確認(Method Validation)是兩個重要的概念。它們在實際應用中有所不同,但也有聯系。下面我們將探討這兩個過程的區別與聯系,并配合表格進行說明。
方法驗證 (Method Validation)
方法驗證是一系列的實驗室活動,用于證明一個分析方法的適用性和可靠性。這個過程通常包括以下參數的評估:
特異性?(Specificity)
準確度?(Accuracy)
精密度?(Precision)
檢出限?(Limit of Detection, LOD)
定量限?(Limit of Quantitation, LOQ)
線性?(Linearity)
范圍?(Range)
這些參數確保了該方法能夠在預定的操作范圍內準確地測量特定樣品中的組分。驗證是方法開發的一個部分,通常在引入新方法或對現有方法進行重大修改時進行。
方法確認 (Method Confirmation)
方法確認是在正常操作條件下,通過實際樣品分析來證明方法的有效性和一致性的過程。它確保了在日常使用過程中分析方法能夠持續提供可靠的結果。方法確認可能包括:
穩健性測試?(Ruggedness testing)
系統適應性測試?(System Suitability Testing)
樣品分析
質量控制樣品的分析?(Quality Control Sample Analysis)
這涉及到在標準操作程序下,使用已經驗證的方法對真實樣品進行分析,以監控方法性能是否保持在可接受的范圍之內。
區別與聯系
| 特征 | 方法驗證 | 方法確認 |
|---|---|---|
| 目的 | 確定方法是否科學合理,適用于預定用途 | 確定方法在日常使用中是否可靠 |
| 時期 | 方法開發階段或修改后 | 日常操作中,長期過程 |
| 活動內容 | 準確度、精密度、特異性等的評估 | 使用質控樣品和真實樣品對方法性能的監測 |
| 結果應用 | 方法優化和改進的依據 | 評估分析結果的有效性和一致性 |
兩者的聯系在于,方法驗證是方法確認的前提。只有經過徹底驗證的方法才能進入確認階段,以評估其在日常工作中的表現。方法確認實際上是驗證過程的延續,它確保了方法在常規使用中的可靠性和一致性。
任何分析檢測的目的都是為了獲得穩定、可靠和準確的數據,方法驗證在其中起著極為重要的作用。方法驗證的結果可以用于判斷分析結果的質量、可靠性和一致性,這是所有質量管理體系不可分割的一部分。一般在下列情況下,要求對分析方法進行驗證、確認(或稱證實)或重新驗證:1)首次用于常規檢測前;2)轉到另一個實驗室時;3)對于驗證過的方法,其條件或方法參數發生變化時(例如,儀器性能參數發生改變或樣品基質不同時),并且這種變化超出了方法的原適用范圍。
對實驗室有影響的法規和質量管理標準一般都要求進行方法驗證。有的法規中直接使用“驗證或確認”一詞,并列出特定參數,也有的法規用這樣的陳述暗示驗證要求——“檢測方法應適合于預期用途。”
1. 國內主要法規標準
國內第三方檢測機構一般均非標準制修訂機構,方法驗證或確認的來源基本來自資質認定或實驗室認可的要求,主要依據如下:
2.1 CNAS-CL01:2006
l 5.4.2方法選擇:實驗室制定的或采用的方法如能滿足預期用途并經過確認,也可使用。所選用的方法應通知客戶。在引入檢測或校準之前,實驗室應證實能夠正確地運用這些標準方法。如果標準方法發生了變化,應重新進行證實。
l 5.4.5.2 實驗室應對非標準方法、實驗室設計(制定)的方法、超出其預定范圍使用的標準方法、擴充和修改過的標準方法進行確認,以證實該方法適用于預期的用途。確認應盡可能全面,以滿足預定用途或應用領域的需要。實驗室應記錄所獲得的結果、使用的確認程序以及該方法是否適合預期用途的聲明。
l 5.4.5.3 按預期用途進行評價所確認的方法得到的值的范圍和準確度,應與客戶的需求緊密相關。這些值諸如:結果的不確定度、檢出限、方法的選擇性、線性、重復性限和/或復現性限、抵御外來影響的穩健度和/或抵御來自樣品(或測試物)基體干擾的交互靈敏度。
2.2 實驗室資質認定評審準則
l 5.3.2 實驗室應確認能否正確使用所選用的新方法。如果方法發生了變化,應重新進行確認。實驗室應確保使用標準的最新有效版本。
l 5.3.5 實驗室自行制訂的非標方法,經確認后,可以作為資質認定項目,但僅限特定委托方的檢測。
2.3 司法鑒定機構資質認定評審準則
l 5.3.2司法鑒定機構應當證實能否正確使用所選用的標準方法。標準方法發生變化應當重新進行證實。
l 5.3.3司法鑒定機構自行制訂的非標準方法,經省級以上司法行政機關指定的組織確認后,可以作為資質認定項目。
2.4 CNAS-CL02:2013
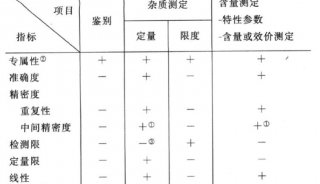
5.5.1.3 檢驗程序的確認:實驗室應對以下來源的檢驗程序進行確認:a) 非標準方法;b) 實驗室設計或制定的方法;c) 超出預定范圍使用的標準方法;d) 修改過的確認方法。方法確認應盡可能全面,并通過客觀證據(以性能特征形式)證實滿足檢驗預期用途的特定要求。(注:檢驗程序的性能特征宜包括:測量正確度、測量準確度、測量精密度(含測量重復性和測量中間精密度)、測量不確定度、分析特異性(含干擾物)、分析靈敏度、檢出限和定量限、測量區間、診斷特異性和診斷靈敏度。)
2.5 CNAS-CL08:2013
l 5.4.4.2 鑒定機構應對非標準方法進行確認以證實該方法適用于預期的用途,并保存使用的確認程序、所獲得的結果、以及該方法是否滿足預期鑒定目的的評價等記錄。
l 5.4.4.3 按預期用途對鑒定方法進行確認時,鑒定機構應有證據證明對影響結果的因素進行了評價。所確認的鑒定方法的值范圍和準確度應與客戶的需求緊密相關,諸如:結果的不確定度、檢出限、方法的選擇性、線性、重復性限和/或復現性限、抵御外來影響的穩健度和/或抵御來自檢材/樣本基體干擾的交互靈敏度。
2.6 其他
CNAS-CL52:2014《CNAS-CL01<檢測和校準實驗室能力認可準則>應用要求》:5.4.2在引入檢測或校準方法之前,實驗室應對其能否正確運用這些標準方法的能力進行驗證,驗證不僅需要識別相應的人員、設施和環境、設備等,還應通過試驗證明結果的準確性和可靠性,如精密度、線性范圍、檢出限和定量限等方法特性指標,必要時應進行實驗室間比對。
CNAS-CL10:2012《檢測和校準實驗室能力認可準則在化學檢測領域的應用說明》:5.4.2 方法的選擇:b) 實驗室應對首次采用的檢測方法進行技術能力的驗證,如檢出限、回收率、正確度和精密度等。如果在驗證過程中發現標準方法中未能詳述但影響檢測結果的環節,應將詳細操作步驟編制成作業指導書,作為標準方法的補充。當檢測標準發生變更涉及到檢測方法原理、儀器設施、操作方法時,需要通過技術驗證重新證明正確運用新標準的能力。 5.4.5 方法確認: a) 任何對標準方法的偏離,都必須進行實驗室確認,即使所采用的替代技術可能具有更好的分析性能。 b) 實驗室應通過試驗方法的檢出限、精密度、回收率、適用的濃度范圍和樣品基體等特性來對檢測方法進行確認。
CNAS-CL09:2013要求:標準方法引入檢測之前,實驗室應證實能夠正確地運用這些方法,并未清晰說明如何證實,而對非標方法的確認提供的參考資料,比如SN/T 3266-2012《食品微生物檢驗方法確認技術規范》;CNAS-CL18:2013規定標準方法必要時才進行技術驗證;CNAS-CL44:2013和CNAS-CL56:2014僅規定非標準方法(包括實驗室自制定方法)才需要確認;CNAS-CL55:2014僅規定:以軟件方式、物理方式或采樣方式等標準未明確的方法進行低輻照度試驗時,實驗室應對該方法進行確認。
除化學領域明確規定應對標準方法進行確認或驗證外,其他領域僅要求對非標方法進行確認或驗證,或者未做規定,而且對確認和驗證是否有區別也未作說明。但是CNAS-CL52:2014是與CNAS-CL01:2006同步應用的,具有等同效力,因此其他領域如未對標準方法確認或驗證進行規定的,應參考CNAS-CL52執行。
2. 國外主要法規標準
2.1 美國FDA
cGMP(藥品動態生產質量管理規范)和GLP(臨床前研究實驗室質量管理規范)等法規要求必須進分析方法的驗證。美國cGMPs 在211.165(e)和211.194 兩小節中提出了驗證要求:
l 165(e):應用檢測方法時,應建立并記錄準確度、靈敏度、專屬性以及重現性。這類驗證及文件制作應按194(a)(2)完成;
l 194(a)(2):實驗室的記錄應包含用于樣品檢測的每個方法的聲明。聲明中應指明建立方法的數據位置,這些數據應能證明該檢測方法在應用于產品檢測時符合特定的準確度和可靠性標準要求。所有檢測方法的適用性應在實際應用條件下得到證實;
l 194(b):如對應用于檢測的已確認方法有任何變更,應保存完整的變更記錄。該記錄中應包含變更原因以及相關數據,以證實方法變更后的樣品檢測結果至少能達到原方法相同的準確度和可靠性;
l FDA GLP 法規21 CFR 第58 部分并未用到“驗證”一詞,但是依據58.113 中的要求,檢查員需要檢查驗證研究記錄:“應采用合適的分析方法進行檢測”,其中“合適的”即意味著驗證。并且FDA 的生物分析方法驗證指南中規定臨床前毒理研究也屬于驗證范圍;
l FDA 關于生物利用度和生物等效性要求的法規21 CFR 320第29節中規定:(a) 用于體內生物利用度研究以檢測體液或排泄物中活性藥物成分或治療成分檢測的分析方法,或用于急性藥理作用檢測的方法,應證明其具有準確性和足夠的靈敏度以及恰當的精密度,能滿足體內的活性藥物成分/治療成分或其代謝產物的實際濃度的檢測要求。
2.2 藥品檢查協定和藥品監察檢查合作計劃(PIC/S)
PIC/S 的使命是“領導制定、實施和維護國際性的、統一的藥品生產質量管理規范(GMP)標準以及藥品領域檢查工作質量體系”。這一使命通過以下手段得以實施:制定和推廣統一的GMP 標準和指導文件;培訓主管部門、尤其是檢查員;評審檢查活動;以及促進主管部門和國際組織的合作和網絡化。目前,約有50個政府組織參加了PIC/S,包話所有的歐盟成員國。許多新的成員國還沒有按照PIC/S GMPs建立自己的GMP 法規。
PIC/S 的GMP 與歐盟的GMP 指令非常相似。兩個文件都在第6.1.5 部分以相同的文字規定了分析方法驗證的要求:分析方法應經過驗證。申請上市許可的所有檢測均應按照批準的方法進行。
在PIC/S 的實驗室現場檢查指南中包含檢查員檢查質量控制實驗室時的一些提問。這些問題包括:
l 方法驗證是不是驗證總體計劃的一部分?
l 有沒有通用的方法驗證SOP?方法驗證報告是否經過正式批準?
l 是否明確驗證目的?
l 是否按ICH規定的參數對每一種方法進行完整的驗證并記錄?
l 是否規定了每種方法的接受限度并能符合該限度規定?
2.3 國際協調會議(ICH)
國際協調會議(ICH)發起于1990 年,匯集了歐盟、日本和美國的監管機構和這三個地區的制藥行業專家,一起討論產品注冊方面的科學和技術問題。
ICH 出版的指導原則,有些被成員國(如歐盟)寫入法律,有些被國家權力機構(如美國FDA)推薦為指南。其中,最為重要的ICH 文件是活性藥物成分的GMP 指南。在第12章中規定了方法驗證的要求:應對分析方法進行驗證,所用方法收載于相關的藥典或其他認可的標準參考文件中的除外。所有檢測方法均應在實際使用條件下證實其適用性;實施分析驗證的程度應能反映分析的目的以及活性藥物成分的生產工藝狀況;開始驗證分析方法前,應考慮對分析設備進行適當的確認。
2.4 美國藥典(USP)
美國藥典(USP)為具體的應用制定方法,并針對FDA 監管的行業內不同的分析特點制定通則。根據聯邦食品藥品和化妝品法案501 部分的規定,USP 方法構成法定標準。USP 制定了兩個與方法驗證有關的通則。
通則<1225>是“法定方法的驗證”。該通則中給出了用于新方法驗證的各種參數。通則中的建議可以被藥品實驗室用作自行制定方法的驗證。
通則<1226>是“法定方法的確認”。該通則用于實施藥典和標準方法的實驗室。這些內容也適用于實驗室應用其他實驗室驗證過的方法。
2.5 ISO/IEC 17025
同CNAS-CL01:2006《檢測和校準實驗室能力認可準則》
以上國內外法規標準中多次出現驗證、確認和證實三個術語,由于國內翻譯問題,經常在標準中將確認和驗證混用或等同。正確的翻譯:Verification譯成確認或證實,Validation譯成驗證,建議參考美國USP。
導致很多實驗室認為方法確認或驗證困難重重原因有四:1)法規標準的翻譯問題,導致理解存在偏差,比如CNAS-CL01:2006中5.4.2所描述的“證實”即與“確認”同義;2)部分法規標準未作詳細說明,比如《實驗室資質認定評審準則》;3)方法確認和方法驗證定義不清,概念搞混;4)國人缺乏研究心態,有點困難就逃避,懶惰之心嚴重。
3. 驗證和確認的定義
3.1 方法驗證(Validation of method)
USP:方法驗證是一個通過實驗室研究來證明程序的性能參數符合期望的分析應用要求的過程。
ICH:分析方法驗證的目的是顯示分析方法適用于它所期望的應用目的。
FDA:方法驗證是一個闡述分析方法適合于其使用目的的過程。
3.2方法確認(Verification of method)
USP<1225>:USP-NF所收載方法的使用者不需要驗證這些方法的準確性和可靠性,但需要確認這些方法在實際使用條件下的適應性。
USP<1226>:確認包括所涉及方法的性能參數,如那些在<1225>中描述的,以建立恰當的、相應的數據,而不是重復驗證的過程。
FDA:出現在USP中的方法被認為已驗證,對于法定方法,廠家必須闡明該方法在實際使用情況下的狀態。
總體來講,方法驗證是闡明方法適合于它使用目的的一個過程,方法確認是通過已驗證的方法進行檢測的條件確實適合于該已驗證方法的過程。、
-
政策法規

-
焦點事件

-
標準

-
標準